أحد الأسئلة المهمة في دراسة الأنظمة الديناميكية الحرارية في الفيزياء هو مسألة ما إذا كان هذا النظام يمكن أن يؤدي بعض الأعمال المفيدة. يرتبط مفهوم الطاقة الداخلية ارتباطًا وثيقًا بمفهوم العمل. في هذه المقالة ، سننظر في ماهية الطاقة الداخلية للغاز المثالي ونعطي صيغًا لحسابها.
الغاز المثالي
حول الغاز ، كحالة تجميع ، والتي ليس لها أي قوة مرنة تحت تأثير خارجي عليها ، ونتيجة لذلك ، لا تحتفظ بالحجم والشكل ، كما يعرف كل تلميذ. يظل مفهوم الغاز المثالي بالنسبة للكثيرين غير مفهوم وغير واضح. دعونا نشرح ذلك.
الغاز المثالي هو أي غاز يستوفي الشرطين المهمين التاليين:
- الجسيمات التي تتكون منها ليس لها حجم. لديهم حجم ، لكنه صغير جدًا مقارنة بالمسافات بينهم بحيث يمكن تجاهله في جميع الحسابات الرياضية.
- لا تتفاعل الجسيمات مع بعضها البعض باستخدام قوى أو قوى فان دير فالطبيعة أخرى. في الواقع ، في جميع الغازات الحقيقية ، يوجد مثل هذا التفاعل ، لكن طاقته لا تذكر مقارنة بمتوسط طاقة الجسيمات الحركية.
الشروط الموصوفة مستوفاة من قبل جميع الغازات الحقيقية تقريبا ، التي تزيد درجة حرارتها عن 300 كلفن ، والضغوط لا تتجاوز الغلاف الجوي. بالنسبة للضغوط العالية جدًا ودرجات الحرارة المنخفضة ، يلاحظ انحراف الغازات عن السلوك المثالي. في هذه الحالة ، يتحدث المرء عن غازات حقيقية. تم وصفها بواسطة معادلة فان دير فال.
مفهوم الطاقة الداخلية للغاز المثالي
وفقًا للتعريف ، فإن الطاقة الداخلية للنظام هي مجموع الطاقات الحركية والطاقات الكامنة الموجودة في هذا النظام. إذا تم تطبيق هذا المفهوم على غاز مثالي ، فيجب التخلص من المكون المحتمل. في الواقع ، نظرًا لأن جزيئات الغاز المثالي لا تتفاعل مع بعضها البعض ، فيمكن اعتبارها تتحرك بحرية في فراغ مطلق. لاستخراج جسيم واحد من النظام قيد الدراسة ، ليس من الضروري القيام بعمل ضد قوى التفاعل الداخلية ، لأن هذه القوى غير موجودة.
وهكذا ، فإن الطاقة الداخلية للغاز المثالي تتوافق دائمًا مع طاقته الحركية. هذا الأخير ، بدوره ، يتم تحديده بشكل فريد من خلال الكتلة المولية لجزيئات النظام ، وعددها ، وكذلك متوسط سرعة الحركة الانتقالية والدورانية. سرعة الحركة تعتمد على درجة الحرارة. ارتفاع درجة الحرارة يؤدي إلى زيادة الطاقة الداخلية والعكس صحيح
صيغةالطاقة الداخلية
تشير إلى الطاقة الداخلية لنظام الغاز المثالي بالحرف U. وفقًا للديناميكا الحرارية ، يتم تعريفها على أنها الفرق بين المحتوى الحراري H للنظام ومنتج الضغط والحجم ، أي:
U=H - pV.
في الفقرة أعلاه ، اكتشفنا أن قيمة U تتوافق مع إجمالي الطاقة الحركية Ekلجميع جزيئات الغاز:
U=Eك.
من الميكانيكا الإحصائية ، في إطار النظرية الحركية الجزيئية (MKT) للغاز المثالي ، يترتب على ذلك أن متوسط الطاقة الحركية لجسيم واحد Ek1يساوي القيمة التالية:
Ek1=z / 2kB T.
هنا kBو T - ثابت بولتزمان ودرجة الحرارة ، ض - عدد درجات الحرية. يمكن الحصول على إجمالي الطاقة الحركية للنظام Ekبضرب Ek1في عدد الجسيمات N في النظام:
Ek=NEk1=z / 2NkB T
وهكذا ، حصلنا على صيغة الطاقة الداخلية للغاز المثالي ، مكتوبة بشكل عام من حيث درجة الحرارة المطلقة وعدد الجسيمات في نظام مغلق:
U=z / 2NkB T.
غاز أحادي الذرة ومتعدد الذرات
صيغة U المكتوبة في الفقرة السابقة من المقال غير ملائمة للاستخدام العملي ، حيث يصعب تحديد عدد الجسيمات N. ومع ذلك ، إذا أخذنا في الاعتبار تعريف كمية المادة n ، فيمكن إعادة كتابة هذا التعبير بشكل أكثر ملاءمة:
ن=N / NA؛ R=NA kB=8 ، 314 J / (مولك) ؛
U=z / 2nRT.
يعتمد عدد درجات الحرية ض على هندسة الجسيمات التي يتكون منها الغاز. وهكذا ، بالنسبة للغاز أحادي الذرة ، z=3 ، حيث يمكن للذرة أن تتحرك بشكل مستقل فقط في ثلاثة اتجاهات من الفضاء. إذا كان الغاز ثنائي الذرة ، إذن z=5 ، حيث تمت إضافة درجتي دوران أخريين إلى درجات الحرية الانتقالية الثلاث. أخيرًا ، بالنسبة لأي غاز متعدد الذرات آخر ، z=6 (3 درجات انتقالية و 3 درجات دوران للحرية). مع وضع ذلك في الاعتبار ، يمكننا أن نكتب بالصيغة التالية الصيغ للطاقة الداخلية لغاز مثالي من أحادي الذرة وثنائي الذرة ومتعدد الذرات:
U1=3/2nRT ؛
U2=5/2nRT ؛
U≧ 3=3nRT.
مثال على مهمة لتحديد الطاقة الداخلية
أسطوانة سعة 100 لتر تحتوي على هيدروجين نقي بضغط 3 أجواء. بافتراض أن الهيدروجين غاز مثالي في ظل ظروف معينة ، فمن الضروري تحديد طاقته الداخلية.

تحتوي الصيغ أعلاه لـ U على كمية المادة ودرجة حرارة الغاز. في حالة المشكلة ، لا يُقال أي شيء على الإطلاق عن هذه الكميات. لحل المشكلة ، من الضروري تذكر معادلة Clapeyron-Mendeleev العالمية. لها المظهر الموضح في الشكل
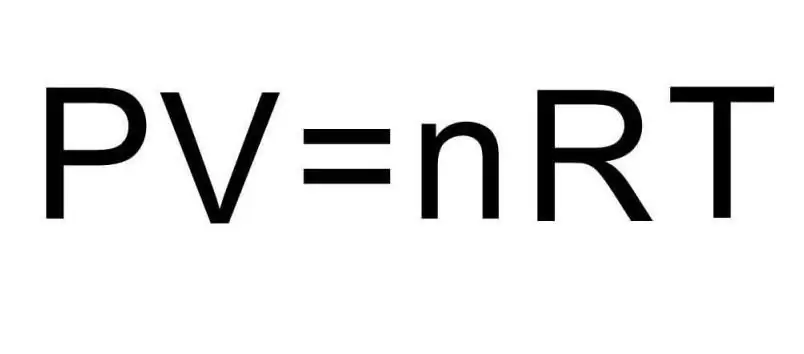
بما أن الهيدروجين H2هو جزيء ثنائي الذرة ، فإن صيغة الطاقة الداخلية هي:
UH2=5/2nRT.
بمقارنة التعبيرين ، نصل إلى الصيغة النهائية لحل المشكلة:
UH2=5/2PV.
يبقى تحويل وحدات الضغط والحجم من الحالة إلى نظام الوحدات SI ، واستبدال القيم المقابلة في الصيغة لـ UH2واحصل على الجواب: UH2 ≈ 76 kJ.






