طريقة قياس الموصلية في التحليل هي قياس الموصلية الإلكتروليتية لمراقبة تقدم تفاعل كيميائي. يتم تطبيق هذا العلم على نطاق واسع في الكيمياء التحليلية ، حيث تعد المعايرة بالتحليل الحجمي طريقة قياسية للتشغيل. ما هو قياس الموصلية؟ في الممارسة الشائعة في الكيمياء التحليلية ، يستخدم المصطلح كمرادف للمعايرة بالتحليل الحجمي ، بينما يستخدم أيضًا لوصف تطبيقات عدم المعايرة بالتحليل الحجمي. ما فائدة استخدام طريقة التحليل هذه؟ غالبًا ما يستخدم لتحديد الموصلية الكلية لمحلول ما أو لتحليل نقطة نهاية المعايرة التي تنطوي على أيونات.
التاريخ
بدأت القياسات الموصلية في وقت مبكر من القرن الثامن عشر ، عندما لاحظ أندرياس بومغارتنر أن المياه المالحة والمعدنية من باد جاستين فيالنمسا توصل الكهرباء. وهكذا ، فإن استخدام هذه الطريقة لتحديد نقاء المياه ، والتي غالبًا ما تستخدم اليوم لاختبار فعالية أنظمة تنقية المياه ، بدأ في عام 1776. وهكذا بدأ تاريخ طريقة قياس الموصلية في التحليل.
واصل فريدريش كولراوش تطوير هذا العلم في ستينيات القرن التاسع عشر ، عندما طبق التيار المتردد على الماء والأحماض والحلول الأخرى. في هذا الوقت تقريبًا ، وجد ويليس ويتني ، الذي كان يدرس تفاعلات حامض الكبريتيك ومجمعات كبريتات الكروم ، أول نقطة نهاية موصلية. بلغت هذه النتائج ذروتها في معايرة الجهد وأداة التحليل الحجمي الأولى بواسطة روبرت بيرند في عام 1883 في معايرة الكلوريد والبروميد HgNO3. وبالتالي ، فإن طريقة قياس الموصلية الحديثة في التحليل تعتمد على Behrend.
هذا التطور جعل من الممكن اختبار قابلية ذوبان الأملاح وتركيز أيونات الهيدروجين ، وكذلك معايرة حمض القاعدة والاختزال. تم تحسين طريقة القياس في التحليل مع تطوير القطب الزجاجي ، والذي بدأ في عام 1909.
المعايرة
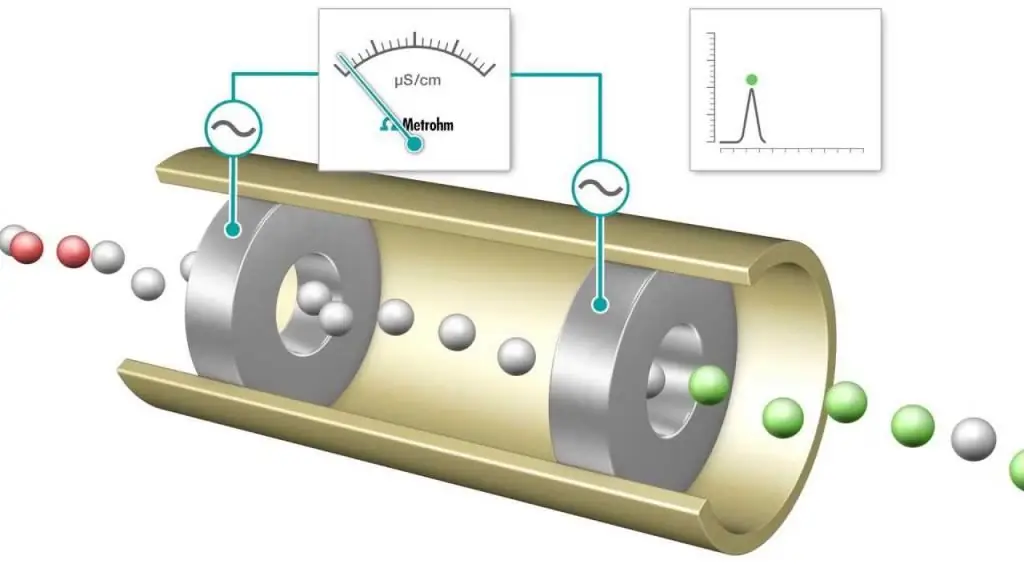
معايرة قياس الموصلية هي قياس يتم فيه مراقبة الموصلية الإلكتروليتية لخليط التفاعل باستمرار عن طريق إضافة كاشف واحد. نقطة التكافؤ هي النقطة التي تتغير فيها الموصلية فجأة. ترتبط الزيادة أو النقص الملحوظ في الموصلية بتغيير في تركيز اثنين من الأيونات عالية التوصيل ، أيونات الهيدروجين والهيدروكسيد. هذه الطريقةيمكن استخدامه لمعايرة المحاليل الملونة أو التعليق المتجانس (مثل تعليق لب الخشب) والذي لا يمكن استخدامه مع المؤشرات التقليدية.
غالبًا ما يتم إجراء معايرة حمض القاعدة والاختزال ، والتي تستخدم مؤشرات مشتركة لتحديد نقطة النهاية ، مثل برتقال الميثيل ، والفينول فثالين لمعايرة الحمض القاعدي ، ومحاليل النشا لعملية قياس الأكسدة والاختزال من النوع اليودومي. ومع ذلك ، يمكن أيضًا استخدام قياسات التوصيل الكهربائي كأداة لتحديد نقطة النهاية ، على سبيل المثال عند ملاحظة محلول HCl مع القاعدة القوية NaOH.
تحييد البروتون
مع تقدم المعايرة ، يتم تحييد البروتونات لتشكيل هيدروكسيد الصوديوم عن طريق تكوين الماء. لكل كمية مضافة من هيدروكسيد الصوديوم ، تتم إزالة عدد مكافئ من أيونات الهيدروجين. في الواقع ، يتم استبدال الكاتيون H + المحمول بأيون Na + الأقل حركة ، وتقل موصلية المحلول المعاير ، بالإضافة إلى الموصلية الخلوية المقاسة. يستمر هذا حتى يتم الوصول إلى نقطة التكافؤ التي يمكن عندها الحصول على محلول كلوريد الصوديوم NaCl. إذا تمت إضافة المزيد من القاعدة ، فهناك زيادة مع إضافة المزيد من أيونات Na + و OH ولم يعد رد فعل التعادل يزيل كمية ملحوظة من H +.

نتيجة لذلك ، عندما تتم معايرة حمض قوي بقاعدة قوية ، يكون للموصلية أدنى حد عند نقطة التكافؤ. هذا الحد الأدنىيمكن استخدامها بدلاً من صبغة المؤشر لتحديد نقطة نهاية المعايرة بالتحليل الحجمي. منحنى المعايرة هو رسم بياني للقيم المقاسة للتوصيل أو التوصيل كدالة لحجم محلول هيدروكسيد الصوديوم المضاف. يمكن استخدام منحنى المعايرة بالتحليل الحجمي لتحديد نقطة التكافؤ بيانياً. طريقة تحليل الموصلية (واستخدامها) وثيقة الصلة بالكيمياء الحديثة.
رد فعل
للتفاعل بين قاعدة ضعيفة الحمضية ، تنخفض الموصلية الكهربائية أولاً إلى حد ما ، حيث يتم استخدام عدد قليل من أيونات H + المتاحة. ثم تزداد الموصلية بشكل طفيف حتى حجم نقطة التكافؤ بسبب مساهمة كاتيون الملح والأنيون (هذه المساهمة في حالة وجود قاعدة حمضية قوية لا تذكر ولا تؤخذ في الاعتبار هناك.) بعد الوصول إلى نقطة التكافؤ ، الموصلية تزيد بسرعة بسبب زيادة أيونات OH.
كاشفات الموصلية (طريقة التحليل لقياس الموصلية) تستخدم أيضًا لقياس تركيزات المنحل بالكهرباء في المحاليل المائية. يمكن الحصول على التركيز المولي للتحليل الذي يخلق موصلية المحلول من المقاومة الكهربائية المقاسة للمحلول.
طريقة قياس موصلية التحليل: المبدأ والصيغ
(2.4.13) C=Constcell1Λm1Res ، حيث تكون Constcell قيمة ثابتة اعتمادًا على خلية القياس ، و Res هي المقاومة الكهربائية التي يقاسها الجهاز (وفقًا لقانون أوم Res=I / V ، وبثابت تسمح لك شدة قياس الجهد V I بحساب الدقة) ، و Λm هي المكافئالموصلية للجسيمات الأيونية. على الرغم من أنه لأغراض عملية يمكن اعتبار Λm ثابتًا ، إلا أنه يعتمد على التركيز وفقًا لقانون كولراوش:
(2.4.14)=Хт Λm0-C ، حيث Θ ثابت ، و Λm0 هي خاصية التوصيل المولي المحددة لكل أيون. الموصلية المولارية ، بدورها ، تعتمد على درجة الحرارة.
سكريت
أدى تطوير طريقة قياس الموصلية لتحليل القياس بالعلماء إلى اكتشافات جديدة. حدد العلماء نسبة التشبع الفائق الحرجة ، Scrit ، باستخدام قياس الموصلية في نظام ترسيب AgCl متجانس يزيد عن أيونات Ag + ، باستخدام التحلل المائي لكلوريد الألكيل كمصدر لأيونات CI ". وجدوا Scrit=1.51 و 1.73 و 1.85 عند 15 و 25 و 35 درجة مئوية على التوالي ، حيث S=([Ag +] [Cl-] / Ksp) 1/2 حسب تعريفهم. إذا تم تحويل هذا التعريف لعامل التشبع الفائق إلى تعريفنا (S=[Ag +] [Cl-] / Ksp) ، فإن النتائج تكون 2.28 و 2.99 و 3.42 ، على التوالي ، في اتفاق جيد إلى حد ما مع نتائج الدراسة الحالية. ومع ذلك ، فإن اعتماد Scrit على درجة الحرارة هو عكس ذلك الموصوف في هذه الدراسة. على الرغم من أن سبب هذا التناقض غير واضح ، فإن الانخفاض في Scrit مع زيادة درجة الحرارة قد يكون معقولًا تمامًا ، نظرًا لأن معدل التنوي يتغير بشكل كبير مع تغيير بسيط في ΔGm/ kT ، وبالتالي ΔGm/ kT ، والذي يتناسب مع T - 3 (lnSm) 2 وفقًا للمعادلة (1.4.12) تعتبر ثابتة تقريبًا مع تغير درجة الحرارة في النظام المعطى. بالمناسبة ، يجب أن يكون تعريف S هو [Ag +] [Cl -] / Ksp ، نظرًا لأن نسبة التشبع الفائق من حيث[AgCl] تركيز المونومر يُعطى مبدئيًا كـ S=[AgCl] / [AgCl] (∞)=[Ag +] [Cl -] / Ksp.
تاناكا و ايواساكي
استمر اثنان من العلماء اليابانيين المشهورين في تاريخ طريقة القياس في التحليل. درس تاناكا وإيواساكي عملية تنوي جسيمات AgCl و AgBr باستخدام طريقة التدفق المتوقف بالاشتراك مع مقياس الطيف الضوئي متعدد القنوات ، وهو أمر مفيد لدراسة عملية سريعة بترتيب مللي ثانية. لقد وجدوا أن بعض مركب هاليد الفضة المحدد AgXm (m-1) ، الذي له نطاق امتصاص للأشعة فوق البنفسجية ضيق نوعًا ما ، تم تشكيله على الفور عندما تم خلط محلول AgC104 بترتيب 10-4 مول dm-3 مع KX (X=Cl أو Br) بترتيب من 10-2 إلى 10-1 مول dm-3 متبوعًا بتحلل سريع يبلغ حوالي 10 مللي ثانية مع تكوين منتج وسيط له امتصاص واسع للأشعة فوق البنفسجية وتغيير أبطأ بكثير في الطيف من المنتج الوسيط. قاموا بتفسير الوسيط على أنه نوى أحادية الانتشار (AgX) n تتكون من جزيئات n وحدد n من النسبة الظاهرة -dC / dt α Cn عند t=0 لتركيزات أولية مختلفة من سلائف C AgXm (m-1) - (n=7 -10 لـ AgCl ، n=3-4 لـ AgBr).

ومع ذلك ، نظرًا لأن السلائف AgXm (m - 1) تتحلل بطريقة غير ثابتة ، فإن نظرية النواة شبه الثابتة لا تنطبق في هذه العملية ، وبالتالي فإن القيمة الناتجة لـ n لا تتوافق مع نقيمة النوى الحرجة. إذا كان المنتج الوسيط يحتوي على نواة أحادية الانتشار ،يتكون من المركب الأحادي ، قد لا يتم الحفاظ على نسبة -dC / dt α C. ما لم نفترض أن المجموعات الأصغر من n-mers في حالة توازن ، ki - 1 ، ici - 1c1=ki ، i - 1ci ، مع بعضها البعض في تفاعل متسلسل c1 → c2 → c3 →… → cn - 1 → cn.، والخطوة الأخيرة فقط cn - 1 → cn لا رجوع فيها ؛ أي c1⇌c2⇌c3⇌… ⇌cn - 1 → cn.
علاوة على ذلك ، يجب افتراض أن تركيزات المجموعات من 2 إلى n-1 لها تركيزات توازن ضئيلة. ومع ذلك ، يبدو أنه لا يوجد أساس لتبرير هذه الافتراضات. من ناحية أخرى ، حاولنا حساب أنصاف أقطار النوى الحرجة ومعاملات التشبع الفائق S في نهاية العملية السريعة ، باستخدام γ=101 مللي جول م -2 للمكعب AgCl19 و γ=109 مللي جول م -2 للمكعب AgBr20 ، بافتراض أن قيم n ، 7-10 لـ AgCl19 و 3-4 لـ AgBr20 ، مكافئة لحجم النوى أحادية الانتشار ، n. أعطت طريقة قياس الموصلية في التحليل ، والتي تتراوح مراجعاتها من مجرد الموافقة إلى الإعجاب ، ولادة جديدة للكيمياء كعلم.
نتيجة لذلك ، اكتشف العلماء الصيغة التالية: r=0.451 نانومتر و S=105 لـ AgCl مع n=9 ؛ r=0.358 نانومتر و S=1230 لـ AgBr مع n=4. نظرًا لأن أنظمتها قابلة للمقارنة مع أنظمة Davis and Jones ، التي حصلت على تشبع فائق حرج لـ AgCl بحوالي 1.7-2.0 عند 25 درجة مئوية. باستخدام قياس موصلية المزيج المباشر بأحجام متساوية من المحاليل المائية المخففة لـ AgNO3 و KCl ، قد لا تعكس قيم S العالية للغاية عوامل التشبع الفائق الفعلية.في حالة توازن مع نوى وسيطة.
امتصاص الأشعة فوق البنفسجية
يبدو من المعقول أن ننسب وسيطًا ذا امتصاص واسع للأشعة فوق البنفسجية إلى نوى أكبر بكثير من المتوسط مع توزيع حجم كبير ناتج عن تفاعل متسلسل غير ثابت. يبدو أن التغيير البطيء اللاحق للنواة المتوسطة مرتبط بنضجها في أوستوالد.

في السياق أعلاه ، اشتق الكيميائي الأمريكي Nielsen أيضًا nحوالي 12 و S المقابل أكبر من 103 لتنوى جزيئات كبريتات الباريوم من قياسات التعكر كدالة للتشبع الفائق ، باستخدام n=dlogJ / dlogC في نظرية Becher-Dering-like للصيغة. (1.3.37) ، ولكن إعطاء (n+ 1) بدلاً من n. نظرًا لأنه تم خلط محاليل أيونات الباريوم وأيونات الكبريتات بشكل مباشر في هذه التجربة ، يجب أن ينتهي التنوي العابر السريع فورًا بعد الخلط ، ويمكن أن يكون ما تم قياسه هو معدل النضج و / أو الاندماج البطيء اللاحق لأوستوالد للنواة المتولدة. على ما يبدو ، هذا هو السبب في القيمة الصغيرة غير المعقولة لـ nوالتشبع الفائق المرتفع للغاية. لذلك ، يجب أن نلاحظ مرة أخرى أن بعض مكامن الأنواع الأحادية التي تطلقها استجابة لاستهلاكها ضروري دائمًا لتحقيق التنوي شبه الثابت في نظام مغلق. تفترض جميع النظريات الكلاسيكية عن التنوي ، بما في ذلك نظرية بيشر دورينج ، مثل هذا الشرط ضمنيًا. تعريف قياس الموصليةتم إعطاء طريقة التحليل في أقسام المقالة أعلاه.
قام علماء آخرون بالتحقيق في عملية التنوي العابر لهاليد الفضة عن طريق التحليل الإشعاعي النبضي للماء المحتوي على هاليد الميثيلين وأيونات الفضة ، حيث يتحلل هاليد الميثيلين لإطلاق أيونات الهاليد بواسطة الإلكترونات المميهة الناتجة عن الإشعاع النبضي في النطاق من 4 نانوثانية إلى 3 ميكرو ثانية. تم تسجيل أطياف المنتجات باستخدام مضخم ضوئي وكاميرا خطية وسلائف هاليد الفضة أحادية اللون تتشكل بمرور الوقت بترتيب ميكروثانية متبوعة بعملية تنوي مشابهة لتلك التي لاحظها تاناكا وإواساكي. تظهر نتائجهم بوضوح أن عملية تنوي هاليدات الفضة عن طريق الخلط المباشر للمواد المتفاعلة تتكون من خطوتين أساسيتين ؛ أي تكوين سلائف أحادية بترتيب μs والانتقال اللاحق إلى نوى بترتيب 10 مللي ثانية. وتجدر الإشارة إلى أن متوسط حجم النوى يبلغ حوالي 10 نانومتر.
تشبع
فيما يتعلق بمعاملات التشبع الفائق لتنوى جسيمات AgCl في الأنظمة المفتوحة التي يتم فيها إدخال تركيزات عالية من المواد المتفاعلة مثل AgNO3 و KCl باستمرار في محلول الجيلاتين طوال فترة الترسيب ، أبلغ Strong و Wey31 عن 1.029 (80 درجة مئوية) - أبلغت 1.260 (40 درجة مئوية) و Leubner32 عن 1.024 عند 60 درجة مئوية كما هو مقدر من قياس معدل نمو جزيئات بذور AgCl عند التشبع الفائق الحرج. هذا هو جوهر طريقة قياس الموصلية للتحليل الكمي.
من ناحية أخرى ، بالنسبة لأنظمة الجسيمات AgBr المفتوحة ، بعضهاالقيم المقدرة لمعامل التشبع الفائق الحرج ، Scrit: Scrit - 1.5 عند 70 درجة مئوية وفقًا لـ Wey و Strong 33 من معدل النمو الأقصى المعتمد على الحجم المحدد من خلال إيجاد عتبة التجديد بمعدلات مختلفة لإضافة محلول AgNO3 إلى KBr محلول في وجود جزيئات البذور بواسطة نفاثات مزدوجة ؛ Scrit=1.2-1.5 عند 25 درجة مئوية وفقًا لـ Jagannathan و Wey34 كعامل التشبع الفائق الأقصى المحدد من معادلة Gibbs-Thomson مع بياناتها على الحد الأدنى لمتوسط حجم النوى الذي يتم ملاحظته بواسطة الفحص المجهري الإلكتروني أثناء خطوة التنوي لترسيب AgBr ثنائي النفاثات. هذا فعال جدا عند تطبيق طريقة قياس الموصلية.

عند حساب قيم Scrit هذه ، أخذوا γ=140 مللي جول متر -2. نظرًا لأن التنوي في الأنظمة المفتوحة يتوافق مع عملية بقاء النوى الناشئة في منطقة محلية عالية التشبع الفائق بالقرب من منافذ المتفاعل ، يتوافق التشبع الفائق مع تركيز المذاب في حالة توازن مع نوى بأقصى حجم ، إذا استخدمنا بيانات Sugimoto35 على أقصى نصف قطر لنواة AgBr في الأنظمة المفتوحة (0.33 نانومتر) مع نظري γ لـ AgBr المكعب (=109 مللي جول م - 2) 3 ، ثم يتم حساب عامل التشبع الفائق الحرج ، Scrit ، كما سيكون 1.36 عند 25 درجة مئوية (إذا افترض أن γ 140 مللي جول / م 2 ، إذن Scrit=1.48).
نتيجة لذلك ، على أي حال ، فإن التشبع الفائق الحرج فيعادةً ما تكون الأنظمة المفتوحة لجسيمات هاليد الفضة أقل بكثير من الحد الأقصى للتشبع الفائق (ربما يكون قريبًا من التشبع الفائق الحرج) في الأنظمة المغلقة. هذا لأن متوسط نصف قطر النوى المتولدة في المنطقة المحلية لنظام مفتوح أكبر بكثير من rmفي نظام مغلق ، وربما يرجع ذلك إلى الاندماج الفوري للنواة الأولية عالية التركيز في المنطقة المحلية لنظام مفتوح ذي ارتفاع تركيز المنحل بالكهرباء المحلي.
التطبيق
تمت دراسة وتحليل استخدام طريقة معايرة قياس الموصلية للتسجيل المستمر أثناء العمليات الأنزيمية على نطاق واسع. تعتمد جميع الطرق التحليلية الكهروكيميائية تقريبًا على التفاعلات الكهروكيميائية (قياس الجهد ، وقياس الجهد ، وقياس التيار ، وقياس الكولوم).
طريقة قياس الموصلية في التحليل هي طريقة إما لا توجد فيها تفاعلات كهروكيميائية على الأقطاب الكهربائية على الإطلاق ، أو أن هناك تفاعلات ثانوية يمكن إهمالها. لذلك ، في هذه الطريقة ، فإن أهم خاصية لمحلول الإلكتروليت في الطبقة الحدودية هي التوصيل الكهربائي ، والتي تختلف وفقًا لمجموعة واسعة إلى حد ما من التفاعلات البيولوجية.
الفوائد
تتمتع المستشعرات الحيوية لقياسات الطاقة أيضًا ببعض المزايا مقارنة بالأنواع الأخرى من محولات الطاقة. أولاً ، يمكن تصنيعها باستخدام التكنولوجيا القياسية ذات الأغشية الرقيقة منخفضة التكلفة. هذا ، إلى جانب استخدام طريقة محسّنة لشل حركة المواد البيولوجية ، يؤدي إلى انخفاض كبير في كل من التكلفة الأولية للأجهزة والتكلفة الإجمالية للتحليل. بالنسبة لأجهزة الاستشعار الدقيقة المدمجة ، من السهل إجراء وضع القياس التفاضلي ، والذي يعوض التأثيرات الخارجية ويحسن دقة القياس بشكل كبير.
تُظهر البيانات بوضوح الإمكانات الكبيرة لأجهزة الاستشعار الحيوية في قياس الموصلية. ومع ذلك ، لا يزال هذا اتجاهًا جديدًا إلى حد ما في أجهزة الاستشعار الحيوية ، لذا فإن تطوير الأجهزة التجارية له مستقبل واعد.
طرق جديدة
وصف بعض العلماء طريقة عامة لقياس pKa عن طريق التوصيل. تم استخدام هذه الطريقة على نطاق واسع حتى حوالي عام 1932 (قبل استخدام طرق قياس الأس الهيدروجيني). طريقة قياس الموصلية حساسة للغاية لدرجة الحرارة ولا يمكن استخدامها لقياس قيم pKa المتداخلة. الميزة المحتملة للعينات التي لا تحتوي على حامل لون هو أنه يمكن استخدامها في محاليل مخففة للغاية ، وصولاً إلى 2.8 × 10-5 م. في السنوات الأخيرة ، تم استخدام قياس الموصلية 87 لقياس pKa لليدوكائين ، على الرغم من أن النتيجة التي تم الحصول عليها كانت 0.7 لكل وحدة أقل من قيمة الرقم الهيدروجيني المقبولة عمومًا.

وصف ألبرت والرقيب أيضًا طريقة لتحديد pKa من قياسات الذوبان. كما هو مذكور أعلاه ، تعتمد القابلية للذوبان على pKa ، لذلك إذا تم قياس القابلية للذوبان عند قيم pH متعددة على منحنى ، فيمكن تحديد pKa. وصف Peck and Benet طريقة عامة لتقدير قيم pKa للمواد الأحادية البكتيرية والثنائية والتذبذبية مع إعطاء مجموعة من قياسات الذوبان ودرجة الحموضة. حصل هانسن وهافليجر على pKa للعينة ، والتييتحلل بسرعة عن طريق التحلل المائي من معدلات انحلاله الأولية كدالة للأس الهيدروجيني في جهاز قرص دوار. تتوافق النتيجة جيدًا مع نتيجة الأس الهيدروجيني / الأشعة فوق البنفسجية ، لكن التحلل يجعل الطريقة الأخيرة صعبة. هذا ، إلى حد كبير ، وصف لطريقة قياس الموصلية في التحليل.






